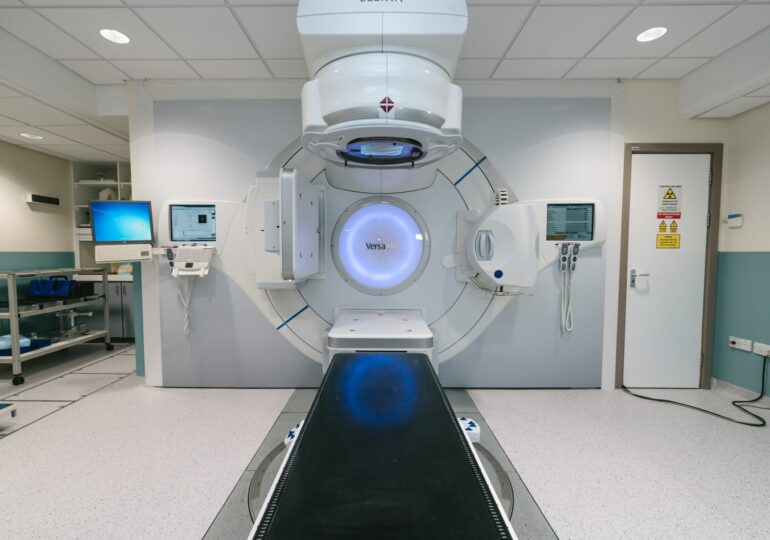
Naukowcy z PG pracują nad technologią poprawiającą efektywność radioterapii – jednej z głównych metod leczenia wielu nowotworów złośliwych. Naświetlania będą mogły być bardziej dokładne, bezpieczne i dostosowane do konkretnego pacjenta – deklarują twórcy metody.
Mają w tym pomóc fantomy żelowe, które umożliwią zwiększenie precyzji dawkowania oraz „celowania” terapeutycznego promieniowania w odpowiednie obszary ciała pacjenta – tak, aby maksymalnie oszczędzić tkanki zdrowe oraz organy krytyczne.
Pracujący nad tym wynalazkiem naukowcy wyrażają nadzieję, że trafi ono do klinik onkologicznych na całym świecie. Już teraz różne szpitale korzystają z tej metody, choć na razie w ograniczonym zakresie – z powodu braku takiej oferty w skali przemysłowej.
– Podstawowym celem metody jest pomoc onkologom w poprawie precyzji naświetlań radioterapeutycznych – mówi pomysłodawca i główny twórca technologii, dr inż. Marek Maryański, profesor Politechniki Gdańskiej, kierownik Zakładu Wielowymiarowych Detektorów Promieniowania Jonizującego Instytutu Nanotechnologii i Inżynierii Materiałowej. Dodaje, że chodzi głównie o leczenie nowotworów, choć nie tylko – radioterapię wykorzystuje się też np. w chorobach naczyniowych czy neurologicznych.
– Nowotwory złośliwe są drugą przyczyną śmiertelności w krajach rozwiniętych, a spośród wszystkich dotkniętych nimi pacjentów ok. 60 proc. kwalifikuje się do radioterapii. Skala zjawiska jest więc ogromna – mówi prof. Maryański. – Problem polega na tym, że – pomimo dynamicznego rozwoju technologii w radioterapii – nadal nie ma adekwatnych metod weryfikacji planów leczenia poszczególnych pacjentów. Bo zanim pacjent zostanie poddany terapii, onkolodzy i fizycy medyczni tworzą plan, który określa trójwymiarową chmurę dawki, jaka zostanie dostarczona choremu.
Profesor tłumaczy, że w radioterapii (jak w wielu innych procedurach medycznych), skuteczność działania zależy od dawki czynnika terapeutycznego. Np. przepisując pacjentowi lek, oblicza się pożądaną liczbę gramów substancji na kilogram masy ciała itp. – Tak samo jest tutaj: obliczamy ilość energii promieniowania na każdy kilogram masy ciała. Wyraża się to w jednostkach zwanych Greyami. Plany leczenia muszą uwzględniać tę wartość, a dodatkowo określać trójwymiarową mapę dawki promieniowania. Trójwymiarową, bo i ciało pacjenta jest trójwymiarowe, i sam guz nowotworowy jest trójwymiarowy. A, żeby leczenie zadziałało, trzeba taki guz zaatakować w całości, we wszystkich jego punktach – mówi naukowiec.
I podkreśla, że chmura dawki, którą traktuje się pacjenta, ma być identyczna z chmurą dawki, którą onkolog radiacyjny wcześniej dla niego zaplanował. – Tu jednak powstaje problem: jak to zweryfikować, żeby mieć absolutną pewność, że nie popełni się błędu. Bo przecież błąd przy dużych dawkach promieniowania – a w medycynie z roku na rok stosujemy coraz większe dawki – wiąże się z ogromnymi negatywnymi konsekwencjami dla pacjenta – mówi.
Profesor tłumaczy, że w takiej weryfikacji chodzi o wielkość dawki i jej rozkład przestrzenny. – Efekt terapeutyczny dla każdej komórki nowotworowej zależy od dawki, jaką ona otrzymała. Komórki żyją w przestrzeni 3D, a my musimy trafić w każdą z nich. Mamy więc dwie zmienne do sprawdzenia: dawkę i położenie. Obecnie stosowane metody weryfikacji są jeszcze mocno zakorzenione w przeszłości, kiedy taka precyzja nie była wymagana. Opierają się więc na pomiarach w bardzo ograniczonej liczbie punktów pomiarowych. Czyli dawki określa się tylko w wybranych punktach z danego obszaru i na tej podstawie szacuje rzeczywisty rozkład przestrzenny. Ale w żadnej z tych sytuacji nie wiemy, co się dzieje poza tymi kilkoma badanymi punktami, czy poza tą jedną wybraną płaszczyzną. Jak rzeczywista dawka rozkłada się w innych miejscach guza, możemy tylko zgadywać – wyjaśnia.
– Nasza metoda jest inna – daje gwarancję, że żaden szczegół nie umknie – podkreśla prof. Maryański. – Po pierwsze: wykrywa wszelkie ewentualne błędy, po drugie: może pomóc zidentyfikować ich przyczyny, dzięki czemu onkolodzy i fizycy medyczni mogą je skorygować przed rozpoczęciem leczenia pacjenta.
Właśnie w takich wypadkach mogą mieć zastosowanie żelowe fantomy, nad którymi pracuje prof. Maryański z zespołem.
– Fantom to obiekt, który w prosty sposób reprezentuje jakąś część ciała pacjenta. Na ogół fantomy zawierają jakieś detektory – substancje czy urządzenia – które pozwalają zmierzyć dawkę promieniowania pochłoniętą w wybranych punktach. Ale, jak wspomniałem wcześniej, w dzisiejszych czasach badanie wybranych punktów nie wystarcza. Trzeba mierzyć precyzyjniej, niejako „gęściej” – zastrzega naukowiec.
Jego metoda wygląda następująco: zaplanowanymi dla pacjenta wiązkami promieniowania naświetla się fantom o bardzo prostej geometrii – jest to po prostu np. kula wielkości ludzkiej głowy. Fantom taki wypełniony jest polimerowo-żelowym detektorem, który zmienia barwę i jej natężenie pod wpływem dawki. Następnie, aby ilościowo scharakteryzować trójwymiarową chmurę dawki, fantom umieszczany jest w tomografie laserowym, który – jak wyjaśnia twórca metody – działa bardzo podobnie jak tomograf rentgenowski, ale jest dużo prostszy i tańszy do zbudowania.
– W efekcie uzyskujemy trójwymiarowy obraz, a do każdego punktu tego obrazu jest przypisana liczba, która wskazuje, jaka dawka promieniowania do niego dotarła – opowiada badacz. – Typowa osiągalna rozdzielczość przestrzenna tej metody to 0,5 mm, nie umknie nam więc żaden błąd.
Dla porównania jedno z najbardziej cenionych obecnie urządzeń dostępnych komercyjnie ma detektory rozmieszczone co 7 mm, w jednej tylko płaszczyźnie. – A proszę sobie wyobrazić, że np. radioterapia choroby nerwu trójdzielnego musi się skupić na zmianie o szerokości ok. 4 mm. Czyli takiej, która jest mniejsza niż rozstaw tych detektorów. W tej sytuacji nie jesteśmy w stanie stwierdzić, czy trafiamy w odpowiednie miejsce. A ponieważ dawka terapeutyczna bywa w leczeniu tej choroby ogromna (około 20-krotnie większa od dawki śmiertelnej dla większości komórek!), jest duże ryzyko, że „trafiając obok” zniszczymy jakąś ważną strukturę zdrowej tkanki, a efekt terapeutyczny będzie niedostateczny – podkreśla prof. Maryański.
Metoda weryfikacji musi być dokładna, a także dostępna, niedroga i szybka, gdyż szpitale nie mogą sobie pozwolić na kilkugodzinne testy pojedynczych pacjentów. Jednocześnie lekarz i pacjent muszą mieć pewność, że leczenie nie będzie obarczone ryzykiem błędu.
– Aby stworzyć taką technologię, potrzeba współpracy wielu różnych specjalistów. My współpracujemy z onkologami, informatykami, optykami, fizykami medycznymi, radiologami, chemikami, elektronikami, matematykami – wymienia profesor. Jego Grupa Projektowa, powołana do życia w ramach grantu „Polskie Powroty” (fundowanego przez NAWA) to obecnie trzy osoby: profesor i dwoje asystentów badawczych, absolwentów Wydziału Fizyki Technicznej i Matematyki Stosowanej PG, w specjalnościach Fizyka Medyczna oraz Nanotechnologia. Dzięki grantom rektorskim IDUB (Inicjatywa Doskonałości – Uczelnia Badawcza) do współpracy angażowani są studenci, w tym magistranci. Grupa współpracuje także z Centrum Onkologii w Bydgoszczy, z Gdańskim Uniwersytetem Medycznym oraz z Instytutem Fizyki Jądrowej PAN, przy którym działa jedyne w Polsce centrum radioterapii protonowej. Współpraca zagraniczna obejmuje trzy wiodące ośrodki radioterapii protonowej w USA i jeden w Belgii.
Fantomy, nad którymi pracuje grupa prof. Maryańskiego, docelowo będą miały dwie wersje. Jedna z nich będzie trwała, co oznacza, że „zapisany” w fantomie obraz chmury dawki utrzyma się „na zawsze”, jak na wywołanej kliszy fotograficznej. W drugiej – wielokrotnego użytku – zapisany obraz utrzyma się przez kilka godzin, po czym zanika, umożliwiając ponowne naświetlenie i użycie fantomu.
W ramach projektu prof. Maryański zaprojektował też i zbudował tomograf laserowy. – Początkowo do skanowania fantomów żelowych używałem standardowych skanerów diagnostycznych do obrazowania jądrowego rezonansu magnetycznego – opowiada badacz z PG. – Jednak to niezupełnie się sprawdziło, ponieważ takie urządzenia nie są w stanie wystarczająco dokładnie zmierzyć wielkości zmian lokalnych wywołanych pochłonięciem dawki promieniowania; dokładność pomiarowa tych skanerów jest stanowczo za mała dla naszych potrzeb. Musieliśmy zatem znaleźć coś dokładniejszego. A ponieważ użyte w naszym fantomie polimery, tworzące się pod wpływem promieniowania, rozpraszają światło (jak niebo i chmury) – czyli wykazują silny efekt optyczny – to można je prześwietlać laserem pod różnymi kątami, a następnie zrekonstruować obraz 3D „gęstości optycznej” tomograficznie.
– Budowa własnego tomografu laserowego okazała się więc rozwiązaniem zarówno najdokładniejszym, jak i najprostszym oraz najtańszym – podsumował profesor.
Zapytany o to, czy uzyskane w czasie skanowania fantomu wyniki idealnie przekładają się na tkankę ludzką, naukowiec zaprzecza i mówi, że nie jest to potrzebne. – Komputery planujące leczenie pacjentów uwzględniają bowiem z wystarczającą dokładnością różnice konturów zewnętrznych oraz gęstości naświetlanych obiektów i poprawnie korygują wynikające z nich różnice rozkładów przestrzennych dawek promieniowania. W pewnym sensie przypomina to zdolność mózgu do korekty niedoskonałości optyki oka. Unikalnym, brakującym ogniwem w tym łańcuchu obliczeń jest natomiast dostarczany przez naszą metodę zbiór wystarczająco gęsto upakowanych danych pomiarowych w trzech wymiarach.
Badacz zaznacza, że omawiany system nadaje się do weryfikacji planów leczenia wszystkich rodzajów radioterapii: dominującej dziś procedury fotonowej, i najnowocześniejszej – protonowej, która jest potencjalnie znacznie skuteczniejsza i dużo droższa. Stosuje ją względnie niewiele ośrodków na świecie, w Polsce zaledwie jeden.
Metodę opartą na żelowych fantomach można też wykorzystywać np. do charakteryzowania radioterapeutycznych wiązek promieniowania ze zdolnością rozdzielczą znacznie większą od metod standardowych i w znacznie krótszym czasie. Może to poprawić jakość danych, na których opiera się planowanie leczenia.
Prof. Maryański wyraża nadzieję, że w przyszłości jego rozwiązanie trafi do tysięcy klinik na całym świecie. Każdy szpital świadczący procedury radioterapeutyczne byłby wyposażony w kompletną aparaturę: fantomy wielokrotnego użytku, tomograf laserowy i specjalne oprogramowanie. Dzięki temu weryfikacja planów leczenia mogłaby odbywać się indywidualnie dla każdego pacjenta, któremu przepisano radioterapię.
W tej chwili przeskanowanie jednego fantomu zajmuje ok. 40 minut. – Jak na warunki szpitalne, to jeszcze stanowczo za długo – mówi profesor. – Lekarze i fizycy medyczni nie mają tyle czasu. Dlatego na razie nasze rozwiązanie zamierzamy oferować klinikom w postaci audytu zewnętrznego. Polega on na tym, że kiedy szpital chce przetestować strategię leczenia jakiegoś konkretnego schorzenia, np. przerzutów mózgowych, może u nas zamówić weryfikację. Tomograf laserowy do odczytu wyników nie jest w tym „usługowym” modelu zlokalizowany fizycznie w danym szpitalu, lecz pozostaje u nas. My wysyłamy nasz fantom kurierem, fizycy medyczni i lekarze w danej placówce naświetlają go zgodnie z przygotowanym planem, po czym odsyłają go nam. Na końcu my na naszym tomografie laserowym wykonujemy skany, analizujemy i przesyłamy gotowe wyniki, ilościowo porównujące nasze pomiary z planowanym rozkładem przestrzennym dawki w fantomie.
– To rozwiązanie tymczasowe, dopóki technologia jest jeszcze w fazie prototypu. Ale finalnie, kiedy uda nam się skrócić czas procedury do maksymalnie 5 minut, będziemy chcieli oferować ją wszystkim klinikom na świecie. I wtedy dla każdego pacjenta będzie można wykonywać indywidualny skan „chmury dawki” w takim fantomie żelowym – opowiada prof. Maryański. – Docelowo cały proces będzie też w pełni zautomatyzowany; nie będzie wymagał nadzoru człowieka. Jedynym zadaniem dla pracownika szpitala pozostanie ułożenie fantomu w odpowiednim miejscu, choć i ten proces może być wysoce zautomatyzowany.